冬瓜的两大食用禁忌注意事项
近日,迪安诊断旗下迪安生物自主研发的人乳头瘤病毒核酸检测试剂盒(荧光PCR法)和人乳头瘤病毒基因分型检测试剂盒(PCR-反向点杂交法),正式获批国家药品监督管理局(NMPA)三类医疗器械注册证(国械注准20243401742、国械注准202...
|
近日,迪安诊断旗下迪安生物自主研发的人乳头瘤病毒核酸检测试剂盒(荧光PCR法)和人乳头瘤病毒基因分型检测试剂盒(PCR-反向点杂交法),正式获批国家药品监督管理局(NMPA)三类医疗器械注册证(国械注准20243401742、国械注准20243401947)。  自2018年获批HPV23分型产品以来,针对两癌筛查与临床宫颈癌诊断,迪安生物已形成横跨多项技术平台、覆盖多种使用场景的产品矩阵。宫颈癌检测产品囊括人乳头瘤病毒检测(多种类别和检测方式)、宫颈液基细胞学检测和p16/Ki-67免疫细胞化学双染检测。已上市HPV检测试剂分别运用PCR-熔解曲线法、PCR-荧光探针法和PCR-反向点杂交法。 我国宫颈癌发病率和死亡率持续攀升 据相关报告,2022年中国宫颈癌发病人数为15.1万,发病率达13.8/10万,位列女性恶性肿瘤发病第五位;死亡病例为5.6万,死亡率达4.5/10万,位列女性恶性肿瘤死亡第六位。数据表明宫颈癌在中国仍然是一个严重的公共卫生问题,需要持续关注并加强防治。 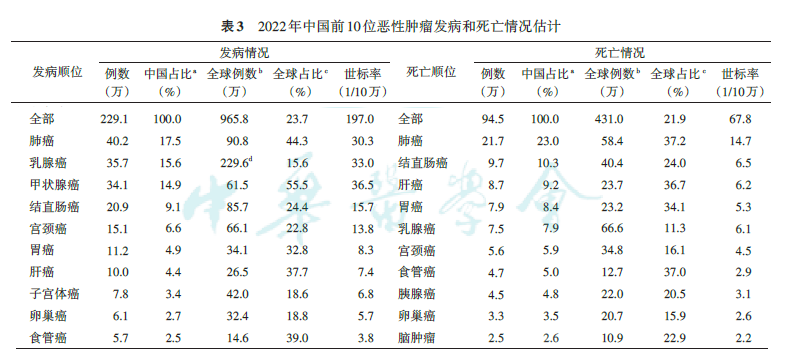 以上数据和图表来源:张希, 杨雷, 刘硕, 等 . 2022 全球恶性肿瘤统计报告解读[J]. 中华肿瘤杂志, 2024, 46(7):10-721. DOI:10.3760/cma.j.cn112152-20240416-00152. 2023年1月,国家卫生健康委、教育部、民政部等10部门联合印发《加速消除宫颈癌行动计划(2022—2030年)》,要求进一步完善宫颈癌防治服务体系,提高综合防治能力。 主要目标 ●到2025年:试点推广适龄女孩HPV疫苗接种服务;适龄妇女宫颈癌筛查率达到50%;宫颈癌及癌前病变患者治疗率达到90%。 ●到2030年:持续推进适龄女孩HPV疫苗接种试点工作;适龄妇女宫颈癌筛查率达到70%;宫颈癌及癌前病变患者治疗率达到90%。 新上市的两款HPV检测试剂盒 迪安生物致力于宫颈癌筛查项目多年,此前获批的人乳头瘤病毒(HPV)核酸分型检测试剂盒(荧光PCR熔解曲线法)深受市场信赖。此次新获批的两款HPV检测试剂盒,进一步丰富了产品线,构建了多元化HPV检测产品矩阵以满足市场多样性需求。 01 人乳头瘤病毒核酸检测试剂盒(荧光PCR法) 即迪安生物HPV2+5+9检测试剂盒  本试剂盒用于体外定性检测女性宫颈脱落上皮细胞样本中的13种高危型人乳头瘤病毒(16、18、31、33、45、52、58、35、39、51、56、59、68)及 3 种中危型人乳头瘤病毒(53、66、82)核酸DNA。 ●最低检测限:100copies/反应 ●包装规格:24 测试/盒、48 测试/盒、96 测试/盒 ●有效期:12个月 02 人乳头瘤病毒基因分型检测试剂盒(PCR-反向点杂交法)即迪安生物HPV17检测试剂盒  本试剂盒用于体外定性检测女性宫颈脱落上皮细胞中的17种中高危型人乳头瘤病毒(HPV16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82)核酸DNA,并可对试剂盒检测范围内的HPV型别进行分型鉴定。 ●最低检测限:100copies/反应 ●包装规格:单管单测试:24 测试/盒、48 测试/盒、96 测试/盒;非单管单测试:48 测试/盒、96 测试/盒。 ●有效期:12个月 迪安生物宫颈癌检测整体解决方案 迪安生物宫颈癌检测整体解决方案可实现1次采样,3项检测(细胞学+HPV检测+P16/Ki-67双染),“互联网+AI”赋能的宫颈癌检测管理模式。  |
文明上网理性发言,请遵守国家法律法规。